摘要:抗体药物偶联物(ADC)作为一类革命性的靶向抗癌药物,其从概念验证到最终临床应用过程漫长而严谨。本文系统概述了ADC药物完整的临床开发路径,包括早期靶点选择与分子设计、临床前药效与安全性评估、以及循序渐进的I、II、III期临床试验的核心目标与设计要点。文章旨在解释“临床试验阶段”的科学内涵,阐明新药上市所必需的科学验证步骤与时间线,以增进公众对药物研发复杂性和严谨性的理解。
1.引言:ADC的概念与开发意义
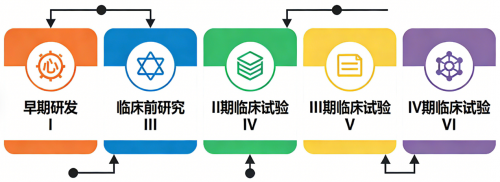
抗体药物偶联物(Antibody-Drug Conjugate, ADC)通过一个可切割或不可切割的连接子,将能特异性识别肿瘤细胞表面抗原的单克隆抗体与高效细胞毒性药物(即有效载荷)共价结合,从而实现了对癌细胞的精准靶向杀伤,被誉为“生物导弹”。这一设计旨在兼具抗体的高靶向性和细胞毒素的强大杀伤力,同时最大限度地减少对正常组织的毒副作用。然而,将一个初步的科学构想转化为安全有效的临床药物,需要历经一段耗资巨大、耗时漫长且淘汰率极高的系统化开发旅程。此过程通常包括早期研发、临床前研究、三期临床试验及上市后监测等多个阶段,全程往往超过十年,具体时长因药物分子特性、监管要求、试验进度等因素存在差异。理解这一路径,不仅有助于认识现代药物研发的科学严谨性,也能让公众更理性地看待医学进步的节奏与挑战。
2. 早期研发与临床前研究:从靶点到候选分子
ADC药物开发始于一个关键的科学假说:针对某一在肿瘤细胞上特异性高表达、而在正常组织中低表达的抗原,可以设计出具有治疗窗口的靶向疗法。理想的靶点(如HER2、TROP-2、CD79b等)是研发成功的基石。靶点确定后,便进入分子精密设计与优化阶段,这涉及三个核心元件的筛选与组合:首先是抗体部分,需具备高亲和力、高特异性、良好药代动力学特性以及诱导内吞的能力;其次是通常部分有效载荷为经改造的、效力比常规化疗药物强数百倍的细胞毒性分子(如微管蛋白抑制剂DM1或DNA损伤剂依沙替康衍生物SN-38);最后是连接子,其必须在血液循环中保持高度稳定以防止脱靶毒性,同时在进入肿瘤细胞后又能被有效切割以释放毒素。确定三者的最佳结合方式与药物抗体比(DAR)是化学与工艺开发重点。
完成分子设计后,候选ADC需经过一系列严格的临床前研究评估,这是通向人体试验的必经之路。体外研究主要在培养的肿瘤细胞系中进行,以验证其靶向结合、内吞、细胞内药物释放及杀伤活性,并初步探索作用机制。体内研究则在携带人类肿瘤的动物模型(如小鼠)中开展,评估其抑制肿瘤生长的疗效、初步的药代动力学特征(吸收、分布、代谢、排泄)及潜在的毒性信号。最关键的是系统的毒理学研究,通常在两种或以上动物种属(如大鼠和非人灵长类)中进行,旨在发现药物可能对各个器官系统(如骨髓、肝脏、肾脏、神经系统)造成的损害,确定“未观察到不良反应的剂量水平”,从而为首次人体试验设定安全的起始剂量。临床前阶段通常需要2至4年,只有展示出显著疗效、可接受毒性特征以及稳定生产工艺的候选分子,才能向药品监管部门提交新药临床试验申请。
3. 临床试验阶段:人体中的系统验证
获得监管机构批准后,ADC药物便进入临床试验阶段。这是一个分三期、循序渐进的人体系统验证过程,其核心原则是在保障受试者安全前提下,逐步确证药物疗效与风险获益比。
3.1 I期临床试验:安全性探索与剂量确立
I 期试验是 ADC 首次应用于人体(受试者为标准治疗失败的晚期癌症患者),主要目的并非验证疗效,而是评估安全性与耐受性。研究采用剂量递增(爬坡)设计,从极低剂量开始,逐步增加,以观察不同剂量下的不良反应,确定最大耐受剂量和剂量限制性毒性。同时,研究者会详细分析 ADC 在人体内的药代动力学行为,并初步观察任何抗肿瘤活性的信号。该阶段入组人数较少(通常 20-80 人),I 期历时约 1-2 年,具体取决于剂量递增设计、受试者招募进度等,其结果是确定用于后续 II 期试验的推荐剂量。
3.2 II期临床试验:疗效初步验证与适应症探索
在确定了相对安全的剂量后,II期试验旨在特定患者群体中初步验证ADC的抗肿瘤活性,并进一步探索其安全性。研究主要关注客观缓解率(肿瘤显著缩小的患者比例),同时评估无进展生存期、缓解持续时间等指标。此外,该阶段会积极寻找预测疗效的生物标志物(如靶点抗原的表达水平),以识别最可能获益的患者亚群。II期试验可能是单臂的,也可能设置对照组进行初步比较,样本量扩大至几十至上百人,历时约 2-3 年,具体受适应症范围、生物标志物探索难度等影响。成功的II期结果是推进至大规模III期试验关键决策点。
3.3 III期临床试验:确证性研究
III期试验是上市前的确证性阶段,其目的是在严格设计的试验中,最终确证ADC的疗效和安全性,并全面评估其风险获益比。试验设计为大规模(数百至数千名患者)、多中心、随机、对照(通常与当前标准治疗对比),采用盲法以减少偏倚。主要终点通常是能明确体现临床获益的指标,如总生存期或无进展生存期。III 期试验需要证明新药在主要终点上优于或在预设非劣效界值内非劣于标准治疗,且其获益明确大于风险。这是耗时最长(通常3-5年或更久,具体因样本量大小、多中心协调效率等存在差异)、投入资源最多的阶段,其数据是监管机构决定是否批准新药上市的核心依据。
4. 监管审批与上市后研究
III期临床试验成功后,研发者将汇总所有非临床和临床数据,形成庞大的注册申请资料,提交给国家药品监督管理局等监管机构进行审评。监管科学家会极其严格地审查数据的质量、有效性和安全性,这个过程通常需要0.5至2年。只有经审查确认药物疗效确切、质量可控、风险可控后,才会批准其上市销售,并明确其适应症、用法用量及警示信息。
药品获批上市并非研发的终点,而是进入IV期临床试验(上市后研究)阶段。在真实世界的广泛应用中,研究人员将继续监测药物的长期安全性、罕见不良反应,并探索其在其他癌种或联合治疗方案中的新应用,不断优化其临床使用策略。
5. 总结与讨论
综上所述,一款ADC新药从实验室走向病床,是一项融合了生物学、化学、医学、统计学等多学科知识的系统工程,平均需要超过10年时间和数十亿美元的投入,且成功率较低。每一阶段的推进都基于严格的科学验证和对患者安全高度负责。
“临床试验阶段”本质上是一个逐步深入、风险可控的科学探究过程。它绝非简单的“试验”,而是将前期研究成果转化为临床实践的关键转化桥梁,每一步都旨在回答特定的科学问题,并为下一步决策提供证据。理解这一漫长旅程,有助于公众认识到每一个新药背后所凝聚的巨大科学努力和临床价值,从而对医学进步保持合理的期待与信心,并对那些为医学发展做出贡献的临床试验受试者与研究者怀抱敬意。ADC的发展历程,正是现代创新药物研发科学路径的一个生动缩影。
作者:河北广盾科技有限公司